Kumak górski
| Bombina variegata[1] | |||
| (Linnaeus, 1758) | |||

| |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Podtyp | |||
| Gromada | |||
| Rząd | |||
| Podrząd | |||
| Rodzina | |||
| Rodzaj | |||
| Gatunek |
kumak górski | ||
| Synonimy | |||
|
| |||
| Podgatunki | |||
| |||
| Kategoria zagrożenia (CKGZ)[3] | |||
 | |||
| Zasięg występowania | |||
 kumak górski | |||
Kumak górski (Bombina variegata) – gatunek płaza bezogonowego z rodziny kumakowatych (dawniej zaliczany do ropuszkowatych), blisko spokrewniony z kumakiem nizinnym. Cechuje się brązową grzbietową stroną ciała i kontrastującą z nią stroną brzuszną, pokrytą ostrzegawczym deseniem żółci i czerni. Występuje w Europie. Zasiedla różnorodne środowiska. Rozmnaża się w małych, często istniejących krótkotrwale zbiornikach wodnych, niekiedy zanieczyszczonych.
Systematyka
[edytuj | edytuj kod]Kumaki zaliczano niegdyś do gromadzącej prymitywne płazy[4] rodziny ropuszkowatych (Alytidae)[5][4]. Obecnie umieszcza się je w osobnej rodzinie kumakowatych (Bombinatoridae)[3], chociaż niektóre publikacje podają jeszcze starą systematykę[6].
Dawniej wyróżniano 4 podgatunki kumaka górskiego[7][4]:
- B. variegata variegata
- B. variegata kolombatovici
- B. variegata pachypus
- B. variegata scabra
Jednakże B. variegata pachypus została podniesiona do rangi odrębnego gatunku Bombina pachypus. Dokonali tego Lanza i Vanni w 1991, opierając się na danych elektroforetycznych, jak i morfologicznych. Jednakże wielu specjalistów wyraża odmienne zdanie (Ohler 1997, Bologna et al. 2000, Hofman et al. 2007)[2][8].
Genetyka
[edytuj | edytuj kod]Przebadano między innymi mitochondrialny DNA kumaków. Badania te dostarczyły informacji o pochodzeniu gatunku i głównych liniach. Poziom różnorodności genetycznej wewnątrzgatunkowej kumaków nizinnego i górskiego były dla większości zbadanych loci podobne. Kumak górski cechował się większą różnorodnością w przypadku genu oksydazy cytochromowej i znaczne różnice pomiędzy haplotypami, które u kumaka nizinnego są sobie znacznie bliższe. Linia karpacka i alpejska różnią się od siebie w mtDNA statystycznie w 4,7–5,2%, ale poszczególne geny wykazują większe różnice. W przypadku wspomnianej oksydazy cytochromowej w sekwencjonowanym regionie wyniosły 8%, a w dehydrogenazie dinukleotydu nikotynoamidoadeninowego aż 10%[6].
Ewolucja
[edytuj | edytuj kod]Kumak górski i kumak nizinny są ze sobą blisko spokrewnione. Ich dalszym krewnym jest kumak dalekowschodni[6].
Próby wyjaśnienia zasięgów występowania europejskich kumaków pociągnęły za sobą powstanie kilku hipotez. Jedna z nich uznaje, że kumak nizinny i kumak górski powstały na skutek zmian klimatu związanych z jednym z plejstoceńskich zlodowaceń. Przeczy temu zapis kopalny, rozróżniający odrębne linie tych kumaków już od pliocenu. Zlodowacenia plejstoceńskie kumak górski prawdopodobnie przetrwał na Bałkanach i Półwyspie Apenińskim i wtedy powstały główne linie mtDNA, różniące się między sobą w 4,7–5,2%. Inne obszary Europy opanowały w czasie interglacjałów. Na Węgry zwierzę dostało się znad zachodniego Dunaju (Kraj Zadunajski). Populacje północne mogły przemierzyć dwie alternatywne drogi: przedostać się przez Karpaty lub drogą zachodnią znad Dunaju. Obecnie wyróżnia się dwie główne linie gatunku: alpejską (zachodnią) i karpacką (wschodnią), do której zaliczają się też osobniki z północnego wschodu Węgier. Wydaje się, że klad karpacki wykazuje większą stabilność, być może przetrwał on też zlodowacenie w jakichś ostojach na terenie Europy Środkowej. Duże zróżnicowanie genetyczne wskazuje też na rozdrobnienie jego populacji już przed przybyciem na te tereny kumaka nizinnego. Natomiast w zachodniej części Węgier doszło do hybrydyzacji i zastąpienia kumaka górskiego nizinnym[6].
Budowa
[edytuj | edytuj kod]

Kumak górski przypomina wyglądem kumaka nizinnego[5]. Nie zalicza się do dużych płazów: osiąga od 4[4] do 5[5][9][4]–5,5 cm długości[10].
Morfologia
[edytuj | edytuj kod]Płaz ma spłaszczone ciało podtrzymywane przez rozstawione szeroko kończyny[4].
Źrenice cechują się kształtem sercowatym[10], trójkątnym[7] o wierzchołku skierowanym ku dołowi[4]. Bębenek nie występuje, podobnie jak rezonatory samców[7].
Kręgi odcinka krzyżowego kręgosłupa cechują się poszerzonymi wyrostkami poprzecznymi[7]. Długość piszczeli stanowi cechę rozróżniające środkowoeuropejskie kumaki[6].
Występuje dymorfizm płciowy w obrębie palców. Samce rozwijają na opuszkach specjalne zgrubienia. Występują one na pierwszych trzech palcach kończyn przednich[7] oraz na drugim, trzecim i czwartym palcu tylnych łap[4]. W okresie rozrodu towarzyszy im podobny twór na wewnętrznej powierzchni przedramienia[7]. Ma on ciemną barwę. Struktury takie noszą miano modzeli. Samca wyróżniają poza tym masywniejsze ramiona[4].
Niektóre z podanych wyżej cech odróżniają kumaka górskiego od nizinnego. Jednakże aby wiarygodnie zdiagnozować gatunek, należy ocenić całe zespoły, a nie pojedyncze cechy[7]. Dodatkowo w rejonach symapatrycznego występowania tworzą się mieszańce, tak więc diagnostyka na podstawie wyłącznie cech morfologicznych nie zawsze jest możliwa[6].
Skóra
[edytuj | edytuj kod]Zwierzę to wyróżnia się swym ubarwieniem. Wierzchnia strona jego ciała pełni rolę maskującą[4]. Jest brązowa[9], błotnista[4], ciemnooliwkowa[7], szarawa[4], gliniastoszara, ziarnista. Może też być odcieniu zielonkawego, a zdarza się, że i zielonego[5]. Zdobią ją ciemniejsze plamki. Natomiast białe punkciki są rzadkie albo też nie ma ich wcale[7]. Pokrywają ją brodawki[5], na szczycie zaopatrzone w pory i, zwłaszcza w przypadku płci męskiej, w kolce rogowe[4]. Guzki grzbietu są więc ostre i względnie wysokie[7], a skóra jest szorstka w dotyku[4]. W okresie rozrodu tworzą się tam zrogowaciałe narośla stożkowatego kształtu[5]. Ta strona ciała w odróżnieniu od spodniej nie jest tak łatwo dostrzegalna[4]. Podgatunek B. v. scabra charakteryzuje się bardziej kolczastymi brodawkami niż u B. v. variegata[4].
Strona brzuszna zupełnie nie przypomina grzbietowej. Jest gładka w dotyku[4] i zabarwiona jaskrawożółto, pokryta plamami koloru niebieskoczarnego[9] lub też, wedle innej koncepcji opisu, czarną powierzchnię pokrywają żółte plamy. Dotyczy to brzucha, podgardla i brzusznej strony kończyn[10]. Obszary koloru żółtego obejmują delikatne czarne kropki. Na polach czarnych mogą co prawda występować białe punkty, jak u kumaka nizinnego, ale występują one co najwyżej skąpo albo nie ma ich w ogóle[4]. Istnieją też osobniki pomarańczowe[7], ubarwieniem przypominające kumaka nizinnego. Zamieszkują one tereny podgórskie[5]. Opisane umaszczenie sprawia wrażenie marmurkowania[4]. Guzki występują tutaj rzadko rozmieszczone, osiągają też małe rozmiary[5]. Spodnia strona kończyn odpowiada ubarwieniem brzuchowi. Końce palców są jasne[7], koloru żółci lub pomarańczu, jak brzuch zwierzęcia. Odróżnia to B. variegata od B. bombina o palcach ciemnych lub jaśniejszych, ale nie jaskrawych. Kolejna żółta plama może znajdować się u omawianego płaza na tylnej stronie uda. Podgatunek bałkański B. v. scabra wyróżnia się bardziej żółtym brzuchem niż u podgatunku nominatywnego. Jeszcze mniej czarnych plam pokrywa brzuch podgatunku z Dalmacji: B. variegata kolombatovici[4].
Gruczoły skórne B. variegata produkują żrącą wydzielinę. Drażni ona błony śluzowe zainteresowanego zjedzeniem kumaka mięsożercy, ma także działanie wymiotne. Może ona także uczulać[4]. W skórze kumaka górskiego znaleziono peptydy o właściwościach antybakteryjnych. Pierwszym z wyizolowanych peptydów przeciwdrobnoustrojowych, odkrytych na początku lat sześćdziesiątych XX wieku, była bombinina. Odkryto też kolejne. Składają się one z 27 reszt aminoacylowych, przy czym reszty aminokwasowe od 14 do 27 nie różnią się od siebie. Zmienność dotyczy więc fragmentu N-końcowego. Przypominają one bombininę, chociaż nie są z nią identyczne. Działają one w największym stopniu na pałeczkę okrężnicy i gronkowce[11].
Tryb życia
[edytuj | edytuj kod]Tryb życia kumaka górskiego przypomina ten obserwowany u kumaka nizinnego[10].
Jest to zwierzę ciepłolubne[10]. W Europie Środkowej spotyka się je od kwietnia do września[9]. Z końcem września – początkiem października płaz ten udaje się na spoczynek zimowy. Znajduje jamę czy miejsce pod kamieniami lub kłodami drewna, gdzie zapada w stan hibernacji. Okres powrotu do aktywności zależy od podwyższenia się temperatury, przypada więc na czas od marca do maja[7] (wedle innych źródeł jest to marzec – kwiecień[4]). Jeśli żyje w źródłach hydrotermalnych, płaz w ogóle nie musi zapadać w sen zimowy[7].
Może być aktywny w ciągu dnia, spędza go bowiem w wodzie, która chroni go przed wysychaniem[9]. Aktywnie spędza dzień w leśnych kałużach czy zacienionych, zalanych wodą żwirowniach. Najczęściej za dnia przebywa jednak ukryty. Gdy siedzi zanurzony w błocie, nad powierzchnię wystawia tylko oczy. W wodzie rozpościera kończyny ukośnie na boki. Często wypoczywa w płytkiej wodzie. Uaktywnia się wieczorem[4]. Niektóre samice pozostają w zbiornikach wodnych już po skończeniu okresu rozrodczego, aż do jesieni[12].
Kumak pływa za pomocą krótkich, odbijających ruchów nóg. Nierzadko nurkuje. Gdy coś go zaniepokoi, ukrywa się pośród mułu[4].
Jako że wykorzystuje do rozrodu nietrwałe, niewielkie zbiorniki wodne, podatne na zmiany, jego sukces rozrodczy zależy silnie od możliwości przemieszczania się, a także znajomości terenu. Badania tej kwestii przeprowadzono w Rumunii w latach 2003–2005. Nieliczne osobniki odłowiono kilkakrotnie w różnych stawach (prawdopodobnie z powodu lądowego trybu życia tych zwierząt). Na tej podstawie obliczono średnią odległość między stawami, w których kumaki górskie dokonywały rozrodu, wynosiła 161 m dla samców, 172 m dla samic, przekraczając medianę równą w obu przypadkach 122 m. Największa zanotowana odległość pomiędzy takimi stawami pochodzi ze Szwajcarii, z terenów otwartych, wynosząc 240 m. Nie wykazano tutaj istotnych różnic w zależności od płci. Zupełnie inaczej natomiast przedstawiała się zależność pomiędzy rozmiarami zwierzęcia (mierzoną od czubka pyska do ujścia kloaki) i przemierzanymi przezeń odległościami. U samców statystycznie istotna zależność nie istniała. U samic znaleziono taką zależność, co więcej, różnice w zmierzonym wymiarze ciała odpowiadały za 40% różnic w przemierzanej przez płazy odległości. Być może większe, a więc i starsze samice lepiej radziły sobie ze znajdywaniem nowych zbiorników wodnych. Przywołuje się tu także ogólną dla płazów zależność, zgodnie z którą im większa samica, tym więcej jaj wytwarza. Dlatego większe samice, osiągając nowe zbiorniki wodne, zmniejszają przez to konkurencję, na którą narażają swe potomstwo. Dodatkowo im większa odległość pomiędzy zbiornikami wodnymi, tym rzadsze są migracje pomiędzy nimi. Z 75 stawów obecnych na terenie zajmowanym przez populację z Rumunii, 65 było objętych migracją, a w 21 odnotowano rozród (nie wszystkie były dlań odpowiednie w bardziej suchych sezonach). Mniejsze, niezdatne do rozrodu zbiorniki mogą też służyć jako przystanki podczas podróży. Kumaki wcześniej spotkane w stawie odławiano też na lądzie, w odległości nie przekraczającej 1300 m. Wcześniejsze badania Gollmana i współpracowników wykazały, że w austriackim lesie mieszanym poprzecinanych terenami trawiastymi samce przemierzały pomiędzy odłowami od 90 do maksimum 980 m, podczas gdy samice 150 m, maksymalnie 600 m. W Starej Płaninie w Bułgarii płazy te przebywały mniejsze dystanse: 64 m w przypadku samców i 20 m u płci przeciwnej. Fakt, że nie złapano w cytowanym badaniu rumuńskim osobników młodych z poprzedniego sezonu przemawia za emigracją tych osobników. Największe dystanse przebywają one podczas pierwszych 2–3 lat życia po przyjęciu postaci dorosłych płazów, o czym pisali w 2000 Gollmannowie, według których bezogonowy nabywa także w ten sposób wiedzy odnośnie do otaczającego go środowiska. Nie muszą one jednak wtedy zaglądać do miejsc rozrodu. Być może niektóre z nich wracają do miejsc, w których przyszły na świat, gdy dojrzeją do wydania nowego pokolenia. Z drugiej strony nowo utworzone po opadach zbiorniki zdatne do rozrodu były przez B. variegata szybko zajmowane. Nie można jednak wykluczyć, że młodych kumaków górskich nie łapano z uwagi na znaczną umieralność, ale ten okres życia wiąże się z największych rozpraszaniem się zwierząt także u innych płazów, takich jak kumak nizinny czy ropucha paskówka[13].
Przebywane przez kumaki dystanse mogą też zależeć od pory roku. Latem w Niemczech odnotowano pokonywanie dystansu 20–30 m. Natomiast w drodze do swych zimowych siedlisk zwierzęta przebywały do 650 m. Rolę mogą tu odgrywać także warunki pogodowe. Samice przebywają większe dystanse wraz ze wzrostem opadów. Być może testują dzięki temu większą liczbę zbiorników pod kątem przydatności do rozrodu, a podczas deszczowej pogody więcej miejsc się do tego nadaje. Samice mogą nawet konkurować o to, które wcześniej zajmą nowe miejsca rozrodu. Podobnej zależności nie wykazano u samców[13].
Natomiast w innym badaniu, przeprowadzonym w okolicach Zurychu, 75% samców i 85% samic zawsze znajdywano w tym samym lub w jednym z przyległych stawów, co wskazuje jednak na przywiązanie kumaka do miejsca[12].
Zaniepokojony na lądzie, kumak górski przybiera pozycje ostrzegawczą[9], czyli tak zwany odruch czy też refleks kumaka[4]. Wygina wtedy grzbiet i odwraca się[10], wyginając ku górze kończyny. Z załamanym ku tyłowi grzbietem[4] pokazuje jaskrawo ubarwiony spód ciała[9], której czarno-żółty wzór ma za zadanie ostrzegać drapieżnika przez spożyciem niejadalnego płaza, pokrytego żrącą, drażniącą i wymiotną wydzieliną gruczołów skóry[4].
Głos tego płaza określa się jako u[4] lub uuh-uuh-uuh. Jest on cichy, lecz melodyjny. Różni się od kumkania kumaka nizinnego częstością drugiej zapisanej frazy, przekraczającą 40/min[10]. U ma się powtarzać dwukrotnie na sekundę. B. variegata kumka więc szybciej i dźwięczniej[4], ciszej i zarazem wyżej[7]. Człowiekowi trudno jest stwierdzić, skąd dochodzi taki głos[4].
Cykl życiowy
[edytuj | edytuj kod]

Cykle życiowe obu środkowoeuropejskich gatunków kumaków nie przedstawiają większych odrębności[5].
Kumak górski rozmnaża się w środowisku wodnym. Wykorzystuje do tego celu nawet najmniejsze zbiorniki wodne[9], często nietrwałe[3]. Ważne, by były ciepłe i płytkie[10], niezacienione, zwłaszcza leżące w lesie lub jego pobliżu[3]. Mogą to być sadzawki o wspomnianych cechach, ale korzysta także z zalanych wodą dawnych wyrobisk żwiru, większych kałuży, a nawet gromadzących wodę kolein[10]. Różni się tym od kumaka nizinnego, preferującego większe, bardziej trwałe zbiorniki[14]. Ważną cechą jest brak innych płazów, a właściwie ich larw. Szczególnie unika żaby trawnej i żaby dalmatyńskiej. Larwy te mogłyby stanowić zagrożenie jako drapieżniki. Udowodniono choćby żywienie się kijanek żaby dalmatyńskiej jajami kumaka górskiego. W takich warunkach znacznie zwiększa się umieralność larw B. variegata. Również obecność kijanek własnego gatunku czyni zbiornik mniej atrakcyjnym[13].
Okres rozrodczy rozpoczyna się 5–10 dni po wkroczeniu do wody[7]. Samce gromadzą się razem, choć usadawiają się w pewnej odległości od siebie, od 35 do 50 cm. Tworzą w ten sposób rewiry[4]. Samce konkurują między sobą, ponieważ liczba samców i samic nie jest identyczna – niekiedy na jedną samicę w obszarze rozrodczym przypada 5 samców (w lesie proporcje są bardziej wyrównane)[12]. Jeśli jakiś samiec wtargnie na teren zajęty już przez innego, jego właściciel odpycha go tylnymi kończynami[4]. Samiec nie posiada worków rezonansowych[4][7], nawołuje jednak samice[10]. Tworzy się w ten sposób kumkający chór. Samce nie ograniczają się jednak do wydawania odgłosów – uderzają nogami w dość regularnym tempie. W ten sposób powstają fale rozchodzące się po powierzchni wody. Zarówno dźwięki, jak i fale stanowią sygnały dla płci przeciwnej. Koncerty odbywają się przeważnie wieczorami i wczesną nocą, niekiedy za dnia. Jeśli temperatury są niskie, zwierzęta mogą kontynuować to zachowanie aż do lata[4]. Wedle Kuzmina rozród trwa aż do sierpnia[7].
Rozród może przebiegać wielokrotnie w czasie tego samego sezonu. Często następuje po ulewnych deszczach, które napełniają tymczasowe zbiorniki wodne[13][12]. Brak odpowiednich warunków z powodu suszy nie powoduje nadrobienia tego przy ich zmianie. Liczba nocy, podczas których odbywa się składanie skrzeku, różni się w zależności od roku, w przeciwieństwie do liczby składanych podczas nocy jaj ani liczby wykorzystywanych do tego zbiorników wodnych[12].
Samica, która jest gotowa do rozrodu, odwiedza rewir zajęty przez samca. Zachodzi ampleksus pachwinowy[4], miedniczy[7]. Polega on na tym, że samiec, wykorzystując opisane wyżej modzele godowe na przedramionach i opuszkach palców, chwyta swą wybrankę w pachwinach[4]. Nie występuje rozdział czasowy pomiędzy ampleksusami a składaniem skrzeku i dojrzewaniem kijanek innych osobników. Niekiedy intensywne składanie skrzeku w niewielkich zbiornikach wodnych następuje po intensywnych letnich deszczach. Jaja tworzą składane porcjami kłęby, liczące od 45 do 100, a nawet więcej jaj[7]. Najmniejszy z kłębów zbieranych w okolicy Zurychu liczył 4 jaja, największy – 960. Średnia wyniosła 84[12]. Matka może również składać je pojedynczo. Umieszcza je na wodnych roślinach, kamieniach, gałęziach, a samiec dokonuje zapłodnienia (zapłodnienie zewnętrzne). Samica może wielokrotnie w tym samym sezonie rozrodczym przystępować do rozmnażania. Tymczasem po złożeniu jaj mija 8 dni, po których wylęgają się larwy zwane kijankami. Dorastają one długości 3–5 cm, nim pod koniec lata przystąpią do przeobrażenia. Nie wszystkie zdążą przejść metamorfozę w pierwszym roku swego życia, niektóre będą zimować w postaci larwalnej. Jednakże brak jednego terminu rozrodu wiąże się z większymi szansami na sukces rozrodczy, zwłaszcza w przypadku płaza wykorzystującego do tego celu efemeryczne zbiorniki wodne, które mogą w niedługim czasie wyschnąć, zabijając potomstwo. Zmniejsza to również konkurencję wśród larw, gdyż zasoby pożywienia w małych zbiornikach nie należą do obfitych[4].
Duże zagęszczenie kijanek zwiększa ich umieralność. W przypadku współwystępowania kijanek w różnym wieku negatywny efekt dotyczy głównie tych starszych[13].
Osobniki młodociane wynurzają się ze zbiorników wodnych między czerwcem a sierpniem. Przed zimowaniem mierzą one od poniżej 15 do 28 mm[12].
Nie wszystkie kumaki górskie osiągają dojrzałość płciową w tym samym czasie. Niektóre już latem, gdy mają około roku, osiągają rozmiary dorosłych płazów. Barandun i współpracownicy wątpią jednak, by przystępowały one do rozrodu. Dojrzałość płciowa zazwyczaj następuje po przeżyciu 2–3 zim, a w niektórych przypadkach jeszcze później[12].
W 1992 oznakowano prawie całą populację i znaleziono tylko nieliczne młode osobniki dorosłe. W innym badaniu 45% złapanych w 1993 osobników zidentyfikowano jako płazy, które odłowiono poprzednio w 1990. Wynika z tego, że chodzi o zwierzęta w wieku minimum czterech lat. W 1991 i 1992 obliczono roczną przeżywalność dorosłych osobników na 58% u samic i 63% u samców (średnio 62%). Jednakże migracje czy kwestie odłowu podważają wiarygodność tego wyniku – w rzeczywistości przeżywalność musi być większa. Brak spadku liczby osobników w bardziej zaawansowanym wieku wskazuje na wysoką przeżywalność. Natomiast różnice pomiędzy płciami w tym względzie wyjaśniają przewagę liczby samców w populacji[12].
Hybrydyzacja
[edytuj | edytuj kod]Pomimo różnych preferencji środowiskowych[14] w rejonach, gdzie spotykają się oba gatunki, odnotowano regularne krzyżowanie się kumaka górskiego z nizinnym[3].
Przykładem takiej okolicy są słowacko-węgierskie obszary krasowe. Gollmann i współpracownicy opisują za Láciem panującą tam szczególną sytuację: kumak górski zamieszkuje dolinę rzeki Slany, podczas gdy kumak nizinny bytuje na wyżej położonych obszarach Silickiej planiny, gdzie panuje cieplejszy klimat, ale też bardziej zaznacza się działalność ludzka. W kilku miejscach napotkano osobniki heterozygotyczne dla wszystkich badanych loci przy nieobecności osobników należących do rozpatrywanych gatunków. Wskazuje to, że mieszańce nie pochodziły bezpośrednio od nich, ale od innych mieszańców. W innych miejscach przeważają osobniki różnego typu przy współwystępowaniu innych. Osobniki czyste gatunkowo zamieszkują centrum omawianego obszaru. Autorzy zwracają też uwagę częste występowanie tam allelu Ldh-lM, co może stanowić efekt dryfu genetycznego, odmiennej presji selekcyjnej na tym obszarze lub błędu przy pobieraniu próbek[14].
Wąska strefa hybrydyzacji wydaje się stabilna. Zjawisko takie tłumaczy się różnymi hipotezami (mniejszym dostosowaniem mieszańców, większym dostosowaniem hybryd do specyficznych warunków w strefie hybrydyzacji, doborem faworyzującym inne allele po obu stronach strefy krzyżowania się). Z uwagi na różnice gatunkowe ostatnia z wymienionych propozycji wydaje się odgrywać największą rolę, choć z drugiej strony zwiększona umieralność zarodków w centrum strefy hybrydyzacji wskazuje na selekcję wymierzoną przeciwko mieszańcom[14].
W Rumunii również istnieje strefa hybrydyzacji zupełnie pozbawiona osobników należących do gatunków rodzicielskich. Strefy hybrydyzacji odnaleziono również w Polsce i w Chorwacji. W tych państwach strefy te są wąskie. Liczą od 6 do 9 km szerokości, jeśli krańce zdefiniuje się poprzez obecność czystych genetycznie przedstawicieli gatunków[6].
Rozmieszczenie geograficzne
[edytuj | edytuj kod]Kumak górski należy do płazów europejskich. Zajmuje większą część Europy Środkowej i Południowej[3], żyje też w Europie Zachodniej[10]. Na zachodzie zasięg jego występowania sięga środkowej Francji, a nawet północnego zachodu tego kraju, gdzie problem stanowi jednak znaczna fragmentacja. W Luksemburgu, jak i w Holandii istnieje po jednej samotnej populacji. Główna część zasięgu przebiega przez środkowe Niemcy (Dolna Saksonia, Turyngia[10]), podczas gdy na północy tego kraju spotyka się izolowane populacje. Obejmuje Karpaty, północ i zachód Szwajcarii i północno-wschodnie Włochy. Izolowane populacje zamieszkują również na Węgrzech. Zasięg zmierza dalej na Bałkany[3].
Lista państw, gdzie występuje, przedstawia się wedle IUCN następująco: Albania, Austria, Bośnia i Hercegowina, Bułgaria, Chorwacja, Czarnogóra, Czechy, Francja, Grecja, Holandia, Liechtenstein, Luksemburg, Macedonia Północna, Niemcy, Polska, Rumunia, Serbia, Słowacja, Słowenia, Szwajcaria, Ukraina, Węgry, Włochy[3]. Inne źródła podają także Belgię, Mołdawię, nie wymieniają zaś Bośni i Hercegowiny[7].
Główna część powyżej opisanego zasięgu odpowiada podgatunkowi Bombina variegata variegata[7]. Spotyka się go we Francji, Beneluksie z pominięciem terenów blisko wybrzeży, na zachodzie i południu Niemiec, w Polsce, Czechach, na Słowacji, w Aplach i na Bałkanach[4]. Inny podgatunek, B. variegata kolombatovici, zamieszkuje tereny byłej Jugosławii: Dalmację i Czarnogórę[7] (niekiedy wymienia się tylko Dalmację[4]). B. variegata pachypus spotyka się we Włoszech[7], na południe od Padu[4]. B. variegata scabra żyje w Grecji, Albanii, Czarnogórze i Bułgarii[7].
W Polsce spotyka się go prawie wyłącznie w Karpatach[9]. Marian Młynarski podaje, że pospolity jest w Karpatach i na pogórzu tego pasma górskiego, a wyspowo występuje także na grzbiecie Wyżyny Krakowsko-Częstochowskiej[5]. Żyje tu podgatunek nominatywny. Wedle niektórych źródeł spotkać go można także na wschodnim przedgórzu Sudetów i Grzbiecie Krakowsko-Chrzanowskim[4].
W Belgii prawdopodobnie płaz wymarł. Taki sam los mógł spotkać populacje zamieszkujące w przeszłości południową Francję. Istnienie izolowanych populacji w Médoc czy Landy wymaga potwierdzenia[3]. W obrębie Basenu Karpackiego płaz występuje wyspowo na terenach górzystych. Jego populacje są w nim otoczone populacjami kumaka nizinnego[6].
Podjęto próbę introdukcji zwierzęcia w Wielkiej Brytanii. Jej efekty dla chwili obecnej nie zostały jeszcze poznane. Państwa tego zazwyczaj nie wymienia się jeszcze, opisując zasięg występowania kumaka górskiego[3].
Region sympatrycznego występowania kumaka nizinnego obejmuje Polskę, Słowację, Węgry, Austrię, Rumunię, Bułgarię i Chorwację[6].
Ekologia
[edytuj | edytuj kod]Płaz zasiedla głównie góry i pogórza[9], a także wyżyny[5]. Zamieszkuje wysokości od 100 do 2100 m nad poziomem morza[3] (niektóre źródła podają do 1900 m n.p.m.[10] czy 1500–2000 m n.p.m.[4]). W Tatrach jego górną granicę zasięgu wyznacza wysokość 1600 m n.p.m.[5][4]
Bombina variegata zasiedla różnorodne siedliska. Należą do nich lasy, zarówno iglaste (zamieszkuje je na większych wysokościach nad poziomem morza, tak jak leśne polany), jak liściaste (w tych żyje zwłaszcza na niższych wysokościach) i mieszane, busz, łąki i inne tereny trawiaste, równiny zalewowe[3]. Wykazuje mniejszą niż swój nizinny krewniak zależność od środowiska wodnego. W okresie słoty urządza wędrówki w poszukiwaniu nowych zbiorników[5].

Płaz zajmuje różnorodne zbiorniki wodne takie jak stawy, jeziora, rzeki, bagna, strumienie (niekiedy o wartkim nurcie[7], choć raczej unika wód płynących[4]) i tworzone przez nie zbiorniki wodne, źródła, w tym także źródła wód mineralnych i termalnych, kałuże[3].
Jako siedliska zajmuje często środowiska wytworzone przez człowieka[10]. Zamieszkuje w rezerwuarach wody, rowach[3], kamieniołomach, piaskowniach, żwirowniach czy gliniankach, w obrębie których znaleźć może płytkie zbiorniki wodne, słabo zarośnięte[3] (nie licząc rzęsy[4]), o niewielkiej powierzchni[10]. Spotykano go nawet w gnojówkach przy gospodarstwach rolniczych[5], a także na torfowiskach wysokich i w dołach potorfowych, cechujących się niskimi pH[4], oraz w wodach silnie zanieczyszczonych, bogatych w sole i kwas siarkowodorowy. Zamieszkuje też parki śródmiejskie[7].
Kumak górski najczęściej zasiedla zbiorniki wodne, w których nie spotka innych płazów. Wyjątkowo dzieli je z kumakiem nizinnym[4].
Pożywieniem kumaka górskiego są głównie stawonogi lądowe, co wiąże się z jego bardziej lądowym trybem życia niż w przypadku kumaka nizinnego. Na brzegach strumieni jego ofiarą padają także bezkręgowce wodne, zwłaszcza Gammaridae[7]. Inne źródło podaje skąposzczety, jak też inne zwierzęta niedużych rozmiarów[4]. Ułamek organizmów wodnych w diecie płaza nie zmienia się z jego wiekiem, w przeciwieństwie do wielkości zdobyczy: starsze kumaki górskie częściej polują na większą zdobycz[7].
Dorosłe kumaki ze względu na toksyczność rzadko padają ofiarą drapieżców. Najczęściej zjadane są przez zaskrońca zwyczajnego[15].
Zagrożenia i ochrona
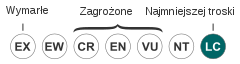
[edytuj | edytuj kod]W 2004 Międzynarodowa Unia Ochrony Przyrody (IUCN) przyznała kumakowi górskiemu status gatunku najmniejszej troski (LC – Least Concern). Istnieje wiele miejsc, gdzie ciągle występuje on pospolicie. Należą do nich Karpaty, w tym Polska, Słowenia. W lasach karpackich osiąga niekiedy znaczne zagęszczenie[3] wynoszące w wielu dogodnych miejscach jednego kumaka na kilka m², dochodzące do jednego osobnika na 0,02 m². Kumak górski uchodzi nawet za najpospolitszego płaza zasiedlającego szeroką gamę środowisk[7].
Zachód i północny zachód zasięgu występowania cechuje się dużą fragmentacją populacji. Miały tam również miejsca lokalne wyginięcia, jak też spadki liczebności. Wśród miejsc takich wymienia się południową Szwajcarię, Niemcy, północno-zachodnią i południową Francję[3]. Zła jest sytuacja na Ukrainie, w obwodzie lwowskim i zakarpackim. W ciągu dwóch minionych dekad miała tam miejsce presja ze strony działalności ludzkiej, która doprowadziła do wyginięcia bezogonowego w 13 lokalizacjach[7].
Pomimo że w skali globalnej gatunek nie jest poważnie zagrożony, niestety całkowita liczebność obniża się. Istnieją różne zagrożenia lokalne. Należą do nich degradacja środowiska naturalnego spowodowana działalnością człowieka, urbanizacja, budowa dróg, przemysł, zwłaszcza związany z wydobyciem i transportem ropy, zanieczyszczenie zbiorników wodnych, choć płaz ten toleruje zanieczyszczenie wody[3], według Młynarskiego nawet silne[5]. Bytuje w nich pomimo znacznego zasolenia i obecności kwasu siarkowodorowego[7]. Poza tym niekiedy rybacy wykorzystują go w roli przynęty. Odławia się go także i sprzedaje, by uczynić zeń zwierzę domowe lub laboratoryjne. Z drugiej strony zwierzęciu zagraża sukcesja ekologiczna terenów uprzednio zmodyfikowanych przez człowieka, na których kumak czuje się dobrze. Przeszkadza mu bowiem zarastanie zbiorników po żwirowniach i gliniankach[3], niekiedy też zbiornikom tym zagraża drenaż[13]. Niekorzystny efekt odgrywa również hybrydyzacja ze swoim krewniakiem Bombina bombina. W Transylwanii hybrydyzacja mozaikowa doprowadziła do utraty czystych genetycznie populacji[3].
Gatunek wymienia załącznik II Konwencji o ochronie gatunków dzikiej flory i fauny europejskiej oraz ich siedlisk (konwencji berneńskiej), jak też załącznik IV dyrektywy siedliskowej (wcześniej II[13]). Podlega także ochronie prawnej w krajach obejmujących większą część jego zasięgu[3], m.in. w Polsce[4]. Jego zasięg występowania obejmuje także wiele obszarów chronionych[3].
Z drugiej strony IUCN zauważa jednak potrzebę ochrony jego siedlisk, zwłaszcza terenów podmokłych. Proponuje nawet ograniczanie sukcesji zarośli i lasów w takich miejscach[3]. Ważną rolę odgrywa również odpowiednie zagęszczenie zbiorników wodnych w rejonach rozrodu[13]. IUCN zauważa też konieczność monitoringu gatunku w pewnych obszarach, wśród których wyróżnia szczególnie miejsca współwystępowania obu kumaków: górskiego i nizinnego, na których zachodzi krzyżowanie się. Stwierdza także możliwość potrzeby reintrodukcji[3].
Przypisy
[edytuj | edytuj kod]- ↑ Bombina variegata, [w:] Integrated Taxonomic Information System (ang.).
- ↑ a b c Darrel R. Frost, Bombina variegata (Linnaeus, 1758), [w:] Amphibian Species of the World: an Online Reference. Version 6.2 [online], American Museum of Natural History, New York, USA [dostęp 2024-06-14] (ang.).
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x Bombina variegata, [w:] The IUCN Red List of Threatened Species (ang.).
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw Günter Diesener, Josef Reichholf: Płazy i Gady. Warszawa: Świat Książki, 1997, s. 50–53, seria: Leksykon Przyrodniczy. ISBN 83-7129-440-9.
- ↑ a b c d e f g h i j k l m n o Marian Młynarski: Płazy i gady Polski. Warszawa: Państwowe Zakłady Wydawnictw Szkolnych, 1966, s. 30–31.
- ↑ a b c d e f g h i Judit Vörös, Marina Alcobendas, Iñigo Martínez-Solano & Mario García-París. Evolution of Bombina bombina and Bombina variegata (Anura: Discoglossidae) in the Carpathian Basin: A history of repeated mt-DNA introgression across species. „Molecular Phylogenetics and Evolution”. 38, s. 705–718, 2006. Elsevier. (ang.).
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af Sergius L. Kuzmin: Bombina variegata Yellow-Bellied Toad. AmphibiaWeb, 1999-09-29. [dostęp 2013-10-19]. (ang.).
- ↑ F. Andreone i inni, Bombina pachypus, [w:] The IUCN Red List of Threatened Species [dostęp 2013-11-24] (ang.).
- ↑ a b c d e f g h i j Wilfried Stichmann: Płazy. W: Wilfried Stichmann, Erich Kretzschmar: Zwierzęta. Warszawa: MULTICO Oficyna Wydawnicza, 1998, s. 186, seria: Spotkania z przyrodą. ISBN 83-7073-185-6.
- ↑ a b c d e f g h i j k l m n o Ulrich Gruber: Płazy i gady, gatunki środkowoeuropejskie. Warszawa: Multico, 1997, s. 21, seria: Świat przyrody. ISBN 83-7073-114-7.
- ↑ Maurizio Simmaco, Donatella Barra, Fernanda Chiarini, Lia noviello, Pietro Melchiorri, Gunther Kreil & Klaus Richter. A family of bombinin-related peptides from the skin of Bombina variegata. „European Journal of Biochemistry”. 199, s. 217–222, 1991. (ang.).
- ↑ a b c d e f g h i Barandun, J; Reyer, H U; Anholt, B. Reproductive ecology of Bombina variegata: aspects of life history. „Amphibia-reptilia”. 18, s. 347–355, 1997. (ang.).
- ↑ a b c d e f g h Tibor Hartel. Movement activity in a Bombina variegata population from a deciduous forested landscape. „North-Western Journal of Zoology”. 4 (1), s. 79–90, 2008. (ang.).
- ↑ a b c d Giinter Gollmann, Petr Roth & Walter Hijdl. Hybridization between the fire-bellied toads Bombina bombina and Bombina variegata in the karst regions of Slovakia and Hungary: morphological and allozyme evidence. „Journal of Evolutionary Biology”. 1 (1), s. 3–14, 1988. Wiley Online Library. (ang.).
- ↑ Małgorzata Łaciak i inni, Tastier than thought? Telemetric research reveals predation on the poisonous yellow-bellied toad Bombina variegata, „Ecology”, 2023, e3996, DOI: 10.1002/ecy.3996.
